第三章 Sigma-1受體對心肌梗死后抑郁大鼠心臟電生理變化的影響研究
第一節 Sigma-1受體對心肌梗死后抑郁大鼠心臟功能的影響
引言
全世界每年因心血管疾病而死亡的人數將近有2000萬,其中一半以上死于心肌梗死(簡稱心梗,myocardial infarction,MI)及其并發癥。在心梗發生、發展過程中常合并焦慮、抑郁等不良情緒,有些患者甚至在心梗發病前就已經罹患抑郁癥。急性心梗患者患抑郁癥的風險是健康人群的3倍,20%~40%的心梗患者并發抑郁情緒、抑郁狀態或抑郁癥。WHO預測抑郁癥將在2020年成為僅次于心血管疾病的第二大疾病。在冠心病的眾多危險因素中,抑郁癥占有重要的位置,抑郁癥患者比健康人患冠心病的風險增加1.3倍,心梗合并抑郁患者的心源性死亡風險是健康人的1.6~2.7倍,新發心血管事件風險為健康人的2倍,以上均表明心梗和抑郁之間相互作用、相互影響。當冠心病和抑郁癥兩者合并時對患者的生存威脅劇增,如何降低冠心病合并抑郁癥的發生率、改善患者生活質量已成為亟待解決的問題。
傳統的心梗治療模式主要包括藥物治療和血運重建術,盡管目前抗血小板治療、強化調脂、β受體阻滯劑等已經得到了廣泛的應用,但是心梗患者一旦合并抑郁癥,其治療效果和預后會大打折扣。抗抑郁治療雖然種類繁多,歸納起來主要包括傳統的藥物治療和以心理干預為主要方式的非藥物治療。非藥物治療由于其療效不顯著,只能起輔助治療作用,而藥物治療或多或少對人體其他系統有一定影響,即使是選擇性5羥色胺再攝取抑制劑(SSRIs)也不是絕對安全的,因此,尋找新的治療方法迫在眉睫。但是治療方法是建立在發病機制基礎之上的,所以,探討心梗和抑郁二者共同的發病機制是關鍵。
目前國內外對心梗和抑郁共病機制的研究主要集中在以下幾個方面:①患者藥物依從性差,缺乏適當運動等行為學機制;②去甲腎上腺素及下丘腦-垂體-腎上腺軸(hypothalamic pituitary adrenal axis,HPA軸)活性增高,內分泌紊亂;③自主神經功能異常,交感與副交感神經系統失衡;④炎癥反應與血小板反應性升高,內皮功能障礙;⑤基因機制;⑥其他機制。
Sigma受體最早被認為是阿片類受體的一個亞型,它存在兩個不同異構體,Sigma-1受體(Sig-1R)和Sigma-2受體(Sig-2R),它們以不同的結合方式及相對分子質量而存在。Sigma-1受體在1996年首次被克隆出來,是一種24kDa的膜蛋白,主要在內質網上表達,廣泛存在于神經系統和周圍器官中,如心臟、肺、肝臟等,具有調節神經傳導、內分泌和免疫功能等多種生理作用。在神經系統,Sigma-1受體通過調節神經可塑性參與抑郁癥的病理生理過程,Sigma-1受體基因敲除后可誘發雄鼠的抑郁樣行為。在心梗或心力衰竭小鼠中,腦Sigma-1受體表達顯著減少,并伴隨抑郁樣癥狀增加,側腦室注射其特異性激動劑后,心功能改善,抑郁樣行為明顯減少。在新生小鼠和成年小鼠的心肌細胞中,Sigma-1受體表達豐富,而在心室肥厚過程中,Sigma-1受體表達減少,并與心力衰竭嚴重程度明顯相關,因此我們推測Sigma-1受體與心梗后抑郁密切相關。
Sigma-1受體在不同器官中表達量不同,如心臟及大腦等。在新生小鼠的心肌細胞中已經檢測到Sigma-1受體的表達,成年小鼠的心肌細胞膜里也可檢測到。心血管功能被一系列復雜途徑影響,這一系列途徑是由Sigma-1受體與心臟和大腦中相應激動劑結合而啟動的。眾多的研究表明,低水平的DHEA-S與心血管疾病的高風險存在著聯系,如缺血性心肌病、所有可能原因引起的致死性疾病等。在心梗模型小鼠中,血漿及腦中Sigma-1受體的表達減少,交感神經的活性增加,與假手術組相比,尿中去甲腎上腺素的量是增多的,其是反映心臟結構及功能的指標,左心室收縮末期直徑較舒張末期直徑縮短的百分數是減少的,左心室重量是增加的。由此可見,Sigma-1受體在心血管疾病,如心力衰竭及心梗等的演變進程中飾演重要的角色。
腦中Sigma-1受體已經被報道是參與精神疾病發病機制的關鍵分子,如抑郁癥或認知障礙等。Sigma-1受體是一種新型的內質網伴侶,參與多種細胞功能如Ca2+信號的調節、炎癥的發生和神經突觸的生長。數據顯示Sigma-1受體調節神經可塑性可能是通過谷氨酸受體通道介導的Ca2+內流加強而使海馬神經元長時程增強進行的,長時程增強是學習和記憶的基礎。神經可塑性過程在神經心理疾病(如嚴重抑郁癥和精神分裂癥)的病理生理過程中發揮重要作用。目前研究已證實大腦中Sigma-1受體表達下調在抑郁癥的發病機制中發揮關鍵作用。在抑郁模型的研究中,研究者發現Sigma-1受體的配體有很好的保護作用。Sigma-1受體調節神經元內Ca2+水平及NMDA介導的生物學作用。瞿偉駿等的研究結果顯示,Sigma-1受體敲除后雄鼠的空間記憶及運動能力下降,提示Sigma-1受體敲除后雄鼠的抑郁樣行為加強。接受抗抑郁藥治療能增加中樞神經系統的Sigma-1受體水平,改善抑郁癥狀。這些研究強烈提示Sigma-1受體有調節神經系統功能的作用。
心梗時梗死相關血管供血的心肌血流完全中斷,心肌出現壞死,若及時開通梗死血管,還可以挽救部分頓抑心肌和冬眠心肌,但是壞死心肌不可能再生,只能瘢痕修復,隨著時間的推移,心梗后心臟發生結構重構,如心肌纖維化、心室壁變薄、心腔變大等,心泵功能會逐步下降,久而久之,出現終末期的心力衰竭。心功能不全是各種器質性心臟病(包括心梗等)的最終歸宿,也是心梗常見的并發癥之一。因此以心功能作為評價指標,來探討心梗和抑郁共同的干預靶點具有重要意義。
因此本實驗通過構建心梗后抑郁大鼠模型,用糖水消耗實驗和曠場實驗對大鼠進行行為學評價,并對各組大鼠進行心功能檢測,用Western Blot檢測心室肌Sigma-1受體的表達情況,以探討心梗和抑郁的共病機制,為心梗后抑郁的防治提供理論基礎。
一、材料和方法
1. 材料
(1) 動物:Wistar大鼠(成年雄性),體重為200~220 g,100只,購買于湖北省疾病預防控制中心,置于武漢市第三醫院動物房飼養,飼養條件符合實驗要求。
(2) 主要實驗儀器:如表3-1所示。

注:其他實驗常用耗材均由武漢大學心血管病研究所提供。
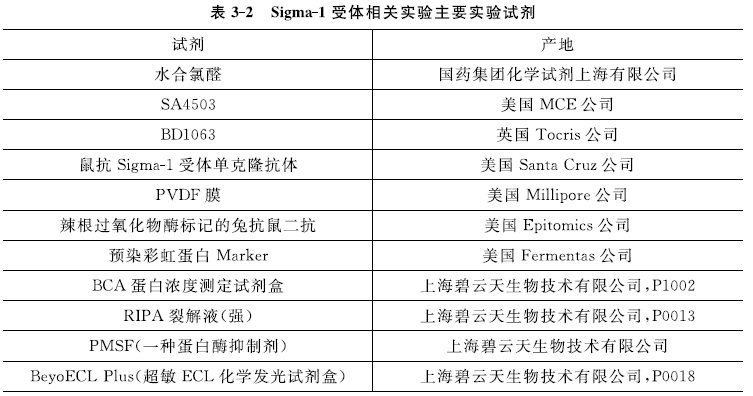
(3) 主要實驗試劑:如表3-2所示。
注:其他實驗常用試劑均由武漢大學心血管病研究所提供。
2. 方法
(1) 分組:Wistar大鼠,雄性成年,200~220g,100只,12h白晝交替條件下適應性生活1周,采用曠場實驗和糖水消耗實驗進行行為學評分,剔除行為異常的大鼠,選行為學得分相近的大鼠隨機分為正常組、心梗組、抑郁組、心梗后抑郁組(模型組)、SA4503組(又稱激動劑組)、BD1063組(又稱拮抗劑組),分別為10、20、10、20、20和20只。
(2) 模型制作方法:心梗后抑郁大鼠模型通過結扎冠狀動脈左前降支和慢性不可預見性溫和應激(CUMS)相結合的方法制作(圖3-1)。
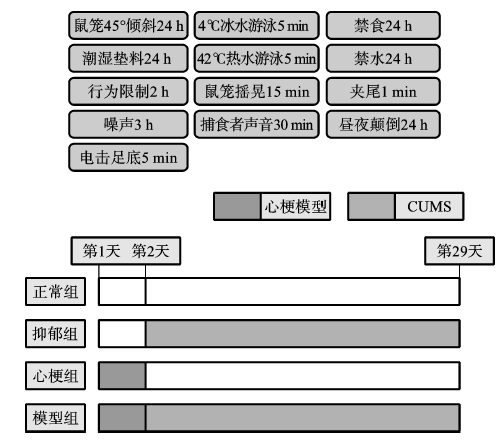
圖3-1 各組大鼠造模示意圖
心梗大鼠模型制作及鑒定:稱取Wistar大鼠,記錄重量,抽取1%戊巴比妥鈉溶液(5 mL/kg),腹腔注射麻醉大鼠,進針后注意回抽是否有血,避免麻醉藥進入血管。觀察大鼠肌力、反應狀態,時間8~15 min;將麻醉好的大鼠仰臥置于木板上固定四肢,逆向剃除頸前區及左胸部的鼠毛。上述操作均在動物準備間進行;手術者對頸前部及左胸部用碘酒進行消毒;助手打開氧氣瓶閥門,調節壓力,打開動物呼吸機開關,調節頻率到70 Hz,連接靜脈置管與氧氣管,調節壓力到2 kPa;術者剪開大鼠頸前部皮膚,用組織鑷逐層分離組織,注意邊分離,邊止血。在環狀軟骨下1~2個軟骨環進行氣管插管,插管時傾斜一定角度,插入后氣管插管與氣管平行進入,注意無阻力感,插入后打開靜脈置管,注意動態觀察動物呼吸機壓力。術者剪開大鼠胸骨旁左側皮膚,逐層分離組織,夾閉肋骨1 min進行止血,然后夾斷第2或第3肋,小心撕開心包膜,找到左心耳,在其起源處往下1~2 mm處結扎冠狀動脈左前降支。以結扎后心電圖ST段抬高、與R波融合作為手術成功的標志,更為直接的證據為缺血區域變白。再次消毒大鼠頸部及心前區皮膚。最后將大鼠放回鼠籠,正常進食水。肌注80萬U青霉素3天,防止感染。
抑郁大鼠模型制作:采用國際上公認的慢性不可預見性溫和應激(CUMS)的方法制作。每天一種,共28天。
(3) 給藥方法
①激動劑組:在模型組的基礎上,從抑郁模型開始制作時每天給予0.03%的SA4503(Sigma-1受體激動劑)1 mL/kg灌胃,直至抑郁模型制作結束,一共28天。
②拮抗劑組:在模型組的基礎上,從抑郁模型開始制作時每天給予0.1%的 BD1063(Sigma-1受體拮抗劑)1 mL/kg腹腔注射,直至抑郁模型制作結束,一共28天。
(4) 行為學評價:包括曠場實驗和糖水消耗實驗,曠場實驗主要檢測大鼠的運動能力和探索行為能力;用糖水消耗實驗中的糖水偏愛百分比作為衡量快感缺乏的有效客觀指標。
曠場實驗:實驗在上午8:00—12:00安靜的房間內、大小為120 cm×90 cm×35 cm內面涂黑的敞箱中進行,測定開始時將大鼠置于曠場正中心,使用動物行為自動跟蹤記錄儀(Ethovision 3.0系統)記錄10 min內大鼠的活動,觀測指標包括大鼠運動的總行程和平均運動速度,研究者根據實驗過程中的觀察記錄直立次數,以大鼠兩前爪懸空或攀附曠場壁算作直立。單只大鼠獨立測試,每次測試完成后,均要將糞便清理干凈,以排除干擾。
糖水消耗實驗:實驗前先訓練大鼠的糖水適應性。用燒杯量取500 mL去離子水;在稱重器置稱量紙一張,調零,稱取5 g蔗糖,注意不要將蔗糖撒到稱量紙之外,保持稱重器干燥;將5 g蔗糖溶于裝有500 mL去離子水的燒杯中,將燒杯置于攪拌器上,調整轉速,注意避免液體濺出燒杯外,待蔗糖完全溶解后,關閉攪拌器,將配好的1%蔗糖溶液灌入飲水瓶中;按上述步驟配好其余飲水瓶的1%蔗糖溶液;每個鼠籠放2瓶糖水,觀察24 h糖水消耗情況。第二個24 h:用燒杯量取500 mL去離子水;按照前述方法配制1%蔗糖溶液;每個鼠籠放置糖水、純水各一瓶,觀察24 h糖水、純水消耗量。再禁水24 h。每只大鼠單獨給予純水和1%蔗糖水各一瓶,2 h后記錄純水及蔗糖水消耗量,再計算糖水偏愛百分比(糖水偏愛百分比=糖水消耗量/總液體消耗量×100%)。
(5) 大鼠心功能檢測:稱取Wistar大鼠,記錄重量,抽取1%戊巴比妥鈉溶液(5 mL/kg),腹腔注射麻醉大鼠,進針后注意回抽是否有血,避免麻醉藥進入血管。使大鼠保持自主呼吸,用超聲心動圖儀進行心功能檢測。將大鼠仰臥固定,剃毛,使心前區暴露,選擇左心室乳頭肌水平短軸面,用7.5 MHz的探頭進行檢查,分別測量左心室前壁厚度(LVAWT)、左心室后壁厚度(LVPWT)、LVEDD、LVESD和LVEF,將這些指標三次測量的結果求平均值。LVFS=(LVEDD—LVESD)/LVEDD×100%。
(6) 取材:待行為學評價和心功能檢測完成后,稱取Wistar大鼠,記錄重量,抽取1%戊巴比妥鈉溶液(5 mL/kg),腹腔注射麻醉大鼠,進針后注意回抽是否有血,避免麻醉藥進入血管。待大鼠意識喪失后,打開胸腔,稍提起心臟,于主動脈根部減去心臟,迅速置于冰上,同時,于冰上除去大鼠左、右心耳,分離出左心室,所取組織立即用錫箔紙包好投入液氮中防止蛋白變性,再分裝在EP管里,在分裝袋和EP管外用記號筆標記清楚,保存于-80 ℃冰箱。
(7) Western Blot檢測心室肌Sigma-1受體蛋白表達量:提取心室肌Sigma-1受體蛋白,利用BCA 蛋白定量試劑盒進行蛋白質定量,使蛋白質變性,準備上樣。電泳、轉膜、免疫反應、化學發光、顯影再定影。GAPDH為參照物,Sigma-1受體的相對表達量為最后結果。
(8) 統計學處理:以各組內參GAPDH表達量為1(100%),計算實驗中各組Sigma-1受體的表達量。所有計量數據均以均數±標準差表示,對于造模行為學、Western Blot及心功能數據,兩組間的比較采用兩個獨立樣本間t檢驗,多組間比較用方差分析。SPSS 21.0軟件為統計工具,P<0.05為差異有統計學意義。
二、結果
1. 動物模型 在制作大鼠心梗模型過程中,因各種原因,包括冠狀動脈破裂、心臟破裂、呼吸循環衰竭等,心梗組、心梗后抑郁組、激動劑組和拮抗劑組大鼠分別死亡4只、6只、7只和6只,在行28天CUMS的過程中,抑郁組、心梗后抑郁組、激動劑組和拮抗劑組分別死亡1只、2只、1只和3只,心梗組在造模后飼養的過程中死亡1只。心梗后抑郁模型制作成功后正常組、心梗組、抑郁組、心梗后抑郁組、激動劑組和拮抗劑組大鼠數量分別為10只、15只、9只、12只、12只和11只。
大鼠心梗模型制作成功后,肉眼看到心肌缺血形成,心電圖提示ST段較結扎前抬高明顯,并與R波融合。心梗前后典型心電圖比較見圖3-2和圖3-3。

圖3-2 大鼠心梗模型心梗前心電圖

圖3-3 大鼠心梗模型心梗后心電圖
2. 動物行為學評價 造模成功后,模型組大鼠糖水偏愛百分比、活動度及探索行為最低,心梗組、抑郁組大鼠糖水偏愛百分比和曠場實驗中的總行程、運動速度及直立次數比正常組都低,P<0.05,差異有統計學意義;激動劑組比模型組行為學評分增加,表現出抗抑郁樣行為,拮抗劑干預后大鼠行為學評分降低,表現出致抑郁樣作用,P<0.05,差異有統計學意義(表3-3)。
曠場實驗:抑郁組、心梗組、模型組比正常組總行程減少、運動速度降低和直立次數減少,P<0.05,差異有統計學意義,說明大鼠活動減少、探索能力下降;與模型組相比,激動劑組大鼠總行程增加、運動速度增加和直立次數增加,拮抗劑組均相反,P<0.05,差異有統計學意義,提示激動劑有抗抑郁作用,而拮抗劑有致抑郁作用(表3-3)。


注:#表示與正常組比較,P<0.05;*表示與模型組比較,P<0.05。
3. 心功能評價 造模前各組大鼠LVAWT、LVPWT、LVEDD、LVESD、LVEF和LVFS之間的差異無統計學意義(P>0.05,表3-4)。

心梗后抑郁模型制作成功后,心梗組、抑郁組、模型組大鼠心功能比正常組低,P<0.05,差異有統計學意義。激動劑干預后,大鼠心功能好轉,拮抗劑干預后,大鼠心功能在模型組的基礎上進一步降低,P<0.05,差異有統計學意義。提示Sigma-1受體激動劑可以改善心梗后抑郁大鼠的心功能,而Sigma-1受體拮抗劑則使其心功能降低(表3-5)。

注:#表示與正常組比較,P<0.05,差異有統計學意義;*表示與模型組比較,P<0.05,差異有統計學意義。
4. 各組大鼠心室肌Sigma-1受體蛋白表達量 與正常組相比,心梗組心室肌Sigma-1受體蛋白表達量減少(37.67±4.92)%,P<0.05,差異有統計學意義;對于模型組,激動劑組和拮抗劑組心室肌Sigma-1受體蛋白表達量分別增加(14.62±9.39)%和減少(28.81±3.21)%,P<0.05,差異有統計學意義(圖3-4、圖3-5)。

圖3-4 Western Blot檢測各組大鼠心室肌Sigma-1受體蛋白表達結果

圖3-5 心室肌Sigma-1受體蛋白相對表達量的結果分析
注:#表示與正常組比較,P<0.05;*表示與模型組比較,P<0.05。
三、討論
本研究發現心梗后抑郁大鼠行為學評分和心功能均顯著下降,Sigma-1受體激動劑SA4503可以提高其行為學評分、改善心功能,起到抗抑郁、改善心梗預后的作用;Sigma-1受體拮抗劑BD1063干預后,行為學評分降低、心功能惡化,表現出致抑郁、促進心梗不良預后的作用。正向和負向調節Sigma-1受體,對抑郁癥和心梗均產生影響,顯示出Sigma-1受體在心梗和抑郁癥中發揮重要作用。
臨床資料表明,心梗后出現抑郁癥是一個常見的現象,從外部因素來講,心梗帶來的胸痛等軀體不適、擔心醫療費用、缺乏足夠的社會關懷及自我價值的否定等因素可能是導致心梗后抑郁癥發生的直接原因;而從身體內部來講,一系列病理生理變化是心梗后出現抑郁癥的直接根源,如交感神經激活、自主神經功能紊亂、HPA軸活性增高等。盡管目前處于再灌注時代,但心梗患者生活質量下降、預后較差仍然沒有得到顯著的改善,一旦合并抑郁癥,這一情況就更加嚴重,抑郁癥是心梗后患者生活質量低下的主要預測因子和心臟性死亡的獨立危險因素。
本研究通過結扎冠狀動脈左前降支和28天慢性不可預見性溫和應激(CUMS)相結合的方法來制作心梗后抑郁大鼠模型,經過多次學習和技術改進,模型制作已經相對穩定,具有可復制性。通過糖水消耗實驗和曠場實驗對動物進行行為學評價。糖水偏愛百分比反映了抑郁癥的核心癥狀:快感缺乏,曠場實驗中的總行程和運動速度反映了大鼠的活動度,直立次數則反映了大鼠的探索行為,對抑郁模型進行了全面而科學的評價。心梗模型主要通過造模時心電圖變化、肉眼觀察,并結合人類心梗時心電圖的變化情況來評估,造模時大鼠心電圖出現ST段抬高并且心尖區變白視為心梗。此造模方法能夠很好地模擬人類心梗后抑郁,為此類疾病的研究提供了模型基礎。
本研究中不但抑郁組行為學評分在正常組的基礎上降低(這也從另一側面驗證了行為學評分對抑郁模型進行評價的可靠性),而且心梗組和心梗后抑郁組大鼠行為學評分也顯著下降,說明心梗和心梗后抑郁大鼠同樣出現抑郁樣行為,這與臨床上心血管疾病特別是心梗患者容易并發抑郁癥是相符合的。對模型組給予Sigma-1受體激動劑和拮抗劑后,分別起到抗抑郁和致抑郁作用,顯示出Sigma-1受體在抑郁癥或抑郁樣行為中起著重要作用。
在目前這種國情下,冠心病的患病人數一年比一年增加,其中最嚴重的心梗也保持著居高不下的患病率和死亡率。心梗患者主要死于心力衰竭和惡性心律失常,所以心功能的評價對心梗患者有著重要的預測意義。本研究中心梗組和模型組心功能比正常組明顯降低,抑郁組心功能部分指標也是降低的,表明抑郁對心梗后的心功能有一定影響。這與HUNT研究的結果是一致的:在無心血管疾病的健康人群中,抑郁與亞臨床左心室功能障礙相關。激動和抑制Sigma-1受體后,大鼠心室肌Sigma-1受體表達量分別增加和降低,心梗后抑郁大鼠的心功能得到改善和進一步惡化,表明心室肌Sigma-1受體對心梗后抑郁大鼠心功能有重要影響。
2010年,在美國據估計有379559人因冠心病而死亡。在英國,這個數字超過65000,因冠心病而死亡的人數高于其他任何疾病。在發展中國家,因心血管疾病而死亡的人數居首位,而其中冠心病的發病率和死亡率呈指數增加。2008年全球估計有730萬人死于冠心病,因此,它成為全世界患病者死亡的主要原因。另一個常見的疾病是抑郁癥。在美國,它影響26%的女性和18%的男性。前瞻性Meta分析研究發現抑郁癥患者出現冠心病的概率較高,這嚴重地影響了公眾的身心健康。因此,尚需進一步研究抑郁癥如何導致冠心病患者的死亡風險增加的潛在機制。最新研究顯示女性患者的這種風險增加。因此,如何降低冠心病合并抑郁癥患者的心臟性事件發生率和猝死率是當前研究的重點和難點。故本研究將急性心梗模型與慢性不可預見性溫和應激模型相結合建立心梗后抑郁模型,然后通過糖水消耗實驗和曠場實驗對實驗模型動物進行行為學評估,并分析藥物干預對心梗后抑郁大鼠行為學、電生理及相關蛋白表達的影響。
最近研究結果顯示,Sigma-1受體是一種新型的內質網分子伴侶蛋白,調節多種細胞功能,如肌醇1,4,5-三磷酸受體(IP3R)介導的鈣信號,離子通道,蛋白激酶定位、激活,細胞氧化還原、神經遞質釋放,炎癥,細胞分化,神經元生存及突觸的發生。在其休眠狀態,Sigma-1受體與伴侶結合形成免疫球蛋白結合蛋白(BiP),其同時也被稱為糖調節蛋白(GRP78)。Sigma-1受體激動劑通過減少內質網Ca2+而引發Sigma-1受體從BiP離解,激活Sigma-1受體伴侶。更為重要的是,即便內質網Ca2+缺失,Sigma-1受體激動劑也能導致BiP從Sigma-1受體解離,導致Sigma-1受體伴侶的激活。同時證明了Sigma-1受體拮抗劑抑制受體激動劑的活性。此受體分子伴侶位于羧基末端,受體激動劑通過激動此受體來緩解內質網應激及氧化應激從而起到神經保護作用。
Sigma-1受體也廣泛表達于外周器官(如心臟和大腦)中。在新生鼠心肌細胞和成人的心肌細胞的細胞膜中已發現Sigma-1受體。此外,與大腦組織相比,左、右心室心肌細胞中表達Sigma-1受體更加豐富。心血管功能可能受到一系列的復雜的機制影響,其中主要由Sigma-1受體結合配體介導完成。最近,Fukunaga和同事報告了左心室Sigma-1受體表達下降參與左心室肥大的進程,Sigma-1受體在左心室的表達量和心力衰竭之間呈顯著的負相關。這些發現表明Sigma-1受體在心臟病的病理生理機制中發揮重要作用。
Bhuiyan等的研究發現心臟Sigma-1受體在壓力超負荷導致的雙側卵巢切除大鼠、主動脈縮窄和壓力超負荷導致的心力衰竭嚙齒類動物中的表達量均下降,氟伏沙明(選擇性5-羥色胺再攝取抑制劑的一種)通過上調Sigma-1受體的表達和刺激Sigma-1受體介導的Akte-NOS信號通路來保護壓力超負荷或主動脈縮窄引起的心肌損傷,顯示心臟Sigma-1受體在心肌肥厚進程中的潛在作用。而且Sigma-1受體激動劑SA4503通過激活血管內皮細胞上Sigma-1受體,提高eNOS-cGMP的表達,修復受損的血管內皮細胞。更早的研究顯示Sigma-1受體激動劑脫氫表雄酮(DHEA-S)通過上調Sigma-1受體來保護心臟避免心肌肥厚。同時Sigma-1受體與BDNF-TrkB組成的信號通路是抑郁癥和心血管疾病聯系的紐帶。在神經系統,Sigma-1受體參與學習、記憶等,與抑郁癥等神經退行性改變疾病相關聯。Shimizu等的臨床研究結果顯示老年抑郁癥患者(年齡>60周歲)進行抗抑郁治療后,隨著抑郁癥狀的改善,血漿中Sigma-1受體濃度升高。Sigma-1受體激動劑將來可能會成為治療精神分裂癥和抑郁癥的藥物。
大量研究發現Sigma-1受體與心臟病有著方方面面的聯系,Sigma-1受體具有抗心律失常,調節心臟收縮和血管舒縮性、緊張性的功能。在心血管疾病研究中,研究者發現給予去除卵巢的大鼠Sigma-1受體激動劑DHEA可緩解壓力誘導的心肌肥厚。Sigma-1受體對心臟功能的影響可能是由離子通道介導的。如前所述,在心血管疾病患者中使用SSRI類藥物具有潛在的安全性問題。然而,最近有結果顯示,SSRI類藥物對心血管疾病患者只發揮了較小的抗抑郁作用。所有SSRI類藥物可通過阻斷5羥色胺轉運蛋白導致整個大腦5羥色胺水平升高,大量數據也表明它們的藥理作用其實非常相似。作為Sigma-1受體激動劑,氟伏沙明顯示了最大的激動效力,而帕羅西汀對Sigma-1受體沒有親和力,舍曲林可能是一種受體拮抗劑。因此,可能是SSRI類藥物在Sigma-1受體上的相似作用部分導致其在心血管疾病的研究中顯示出微弱作用。
脫氫表雄酮增加氟伏沙明誘導的Sigma-1受體的表達,從而起到心臟保護作用,這種作用可以被Sigma-1受體拮抗劑NE-100所拮抗,表明Sigma-1受體在氟伏沙明作用中的用途。相比之下,帕羅西汀(另一個SSRI)對Sigma-1受體的親和力非常低,而且無效。氟伏沙明能夠顯著改善主動脈壓力誘導的心肌肥厚,同時使左心室Sigma-1受體的表達增加。此外,氟伏沙明也減少了左心室肥厚引發的心功能損害,這種心肌保護作用也同樣能被NE-100所抵消。氟伏沙明在切除卵巢的大鼠中通過緩解心肌肥厚誘導的血管損傷而表現出心肌保護作用,和之前一樣,這些影響同樣被NE-100 所拮抗。
根據本實驗的研究結果,我們推測Sigma-1受體在心梗后抑郁的發病中起著重要作用,通過干預Sigma-1受體,可以緩解心梗后抑郁的抑郁癥狀,改善心功能,使預后更好。Sigma-1受體將成為心梗后抑郁的干預靶點之一。
未來我們將利用病毒轉染構建Sigma-1受體基因過表達和沉默模型以及基因敲除模型,從基因水平進一步探討Sigma-1受體在心梗后抑郁中的作用及其機制,同時關于Sigma-1受體的臨床研究也是必不可少的。
四、結論
(1) 抑郁、心梗和心梗后抑郁大鼠的行為學評分下降,表現出抑郁樣行為,Sigma-1受體激動劑和拮抗劑分別提高和降低心梗后抑郁大鼠的行為學評分,表現出抗抑郁和致抑郁作用。
(2) 抑郁、心梗和心梗后抑郁大鼠的心功能下降,Sigma-1受體激動劑和拮抗劑分別改善和惡化心梗后抑郁大鼠的心功能。
(3)心梗大鼠心室肌Sigma-1受體表達量顯著下降,Sigma-1受體激動劑和拮抗劑分別提高和降低心梗后抑郁大鼠心室肌Sigma-1受體表達量。
(4) Sigma-1受體對心梗后抑郁大鼠心功能有重要影響,Sigma-1受體可能是心梗和抑郁的共病機制之一。
第二節 Sigma-1受體對心肌梗死后抑郁大鼠室性心律失常的影響
一、概論
眾多流行病學研究報道心肌梗死(myocardial infarction,MI)后精神疾病,有抑郁癥和認知障礙等。心血管疾病與精神疾病的共存是公認的導致預后不良的因素。數據證明MI患者中有20%~40%并發抑郁情緒、抑郁狀態或者抑郁癥,抑郁不僅降低MI患者的生活質量(這些患者的預后很差),而且抑郁是MI患者心血管事件、心臟性死亡和全因死亡的獨立預測因子,然而直接導致患者死亡的則是心律失常,尤其是室性心律失常。研究已發現室性心律失常是MI合并抑郁患者心臟性猝死的獨立預測因子,并且有動物模型研究結果顯示MI后抑郁大鼠的室顫閾值明顯下降,室性心律失常發生率較對照組有明顯上升的趨勢。對MI后抑郁大鼠室性心律失常具體機制進行研究,并采取可能有效的干預措施,有望降低室性心律失常發生率,進而改善MI并發情緒異常患者的預后,提高其生活質量。
1. Sigma-1受體 研究者開始認為Sigma-1受體是一種阿片類受體,它存在兩個不同異構體,Sigma-1受體和Sigma-2受體,它們以不同的結合方式及相對分子質量而存在;然而,迄今為止,只能克隆出Sigma-1受體。Sigma-3受體是否存在,飽受爭議。克隆研究表明Sigma-1受體是含223個氨基酸的有兩個潛在的跨膜域的受體。最近的一些研究證實了Sigma-1受體在內質網的定位。到目前為止,只有一些電子顯微鏡數據可以清楚地顯示Sigma-1受體胞質膜的定位。在內質網中,Sigma-1受體的第二個跨膜域和受體C端提供了配體結合位點。因此,與大多數的神經遞質受體與配體結合的位點相反,Sigma-1受體的結合位點位于內質網膜腔內表面。配體結合位點的獨特疏水環境可能使疏水分子與結合位點結合。此受體分子伴侶位于羧基末端,受體激動劑通過激動此受體來緩解內質網應激及氧化應激從而起到神經保護作用。Sigma-1受體存在的不同結合位點提示這些受體可能通過多種途徑影響生理和病理過程。綜上所述,Sigma-1受體對神經系統具有顯著影響。
2. Sigma-1受體與抑郁 大腦中Sigma-1受體已經被報道是參與精神疾病發病機制的關鍵分子,如抑郁癥或認知障礙。Sigma-1受體是一種新型的內質網伴侶,參與多種細胞功能如Ca2+信號調節、炎癥和神經突觸生長。
數據顯示Sigma-1受體調節神經可塑性可能是通過谷氨酸受體通道介導的Ca2+內流加強而使海馬神經元長時程增強進行的,長時程增強是海馬學習和記憶的基礎。神經可塑性過程在神經心理疾病的病理生理機制中有重要影響,如嚴重抑郁癥和精神分裂癥。目前研究已證實大腦中Sigma-1受體表達下調在抑郁癥的發病機制中發揮關鍵作用。在抑郁模型研究中應用Sigma-1受體的配體發現其有很好的保護作用。Sigma-1受體調節神經元內Ca2+水平及NMDA介導的生物學作用。瞿偉駿等研究結果顯示,Sigma-1受體敲除后,雄鼠的空間記憶及運動能力下降,提示Sigma-1受體敲除后雄鼠的抑郁樣行為加強。接受抗抑郁藥治療能增加中樞神經系統的Sigma-1受體水平,改善抑郁癥狀。這些研究強烈提示Sigma-1受體有調節神經系統功能的作用。
3. Sigma-1受體與心臟 Sigma-1受體在不同器官中表達量不同,如心臟及大腦等。在新生小鼠心肌細胞、成年小鼠心肌細胞已經檢測出Sigma-1受體。心血管功能被一系列復雜途徑影響,這一系列途徑是由Sigma-1受體與心臟和大腦里激動劑結合而啟動的。眾多的研究表明低水平的DHEA-S與心血管疾病的高風險存在著聯系,如缺血性心肌病、所有可能原因引起的致死性疾病。Sigma-1受體是反映心臟結構及功能的指標。在MI模型小鼠中,血漿及腦中Sigma-1受體的表達減少,交感神經的活性增加,與假手術組相比,尿中去甲腎上腺素的量是增加的,左心室收縮末期直徑較左心室舒張末期直徑縮短的百分數是減少的,左心室重量是增加的。由此可見Sigma-1受體在心血管疾病,如心力衰竭及MI等的演變進程中飾演重要的角色。然而Sigma-1受體和心律失常,尤其室性心律失常的關系仍不清楚。
因Sigma-1受體沒有與哺乳動物蛋白質表現出同源性,所以在實驗系統中基因技術對于研究它們的功能很有幫助。這些研究認可藥理干預的結果,藥理干預有可能成為潛在的治療方法。拮抗劑表示導致受體蛋白質表達下調的藥物。它們通常對自己沒有影響,但減弱Sigma-1受體的刺激的影響。研究中涉及的主要藥物如下:BD1047、BD1063和NE-100。相比之下,Sigma-1受體激動劑表現出受體過表達的表型、本身或其他化合物影響的額外表型。常用的選擇性Sigma-1受體激動劑如下:鎮痛新、PRE084和SA4503。目前許多銷售的藥物(如氟哌啶醇、多奈哌齊、氟伏沙明)與Sigma-1受體相互作用,但無選擇性。Sigma-1受體亞型的作用須使用選擇性藥物來進行仔細嚴格的分析論證。
綜上,冠心病患者心血管事件與抑郁癥的發病機制間存在密切關聯,兩者因果關系復雜,交互作用,但抑郁癥與心血管事件發生之間的具體機制尚不清楚。以前研究者們推想它們之間可能存在著共同的信號通路,Sigma-1受體在兩者共病的發生演變過程中起作用。以此為契機,本研究擬通過結扎冠狀動脈左前降支結合慢性不可預見性溫和刺激建立MI后抑郁大鼠模型,并評價模型動物行為學變化,通過離體電生理方法檢測室性心律失常發生情況,采用Western Blot方法半定量檢測Sigma-1受體蛋白,了解其在各組表達量的差異,進而初步探究Sigma-1受體與室性心律失常的關系,為更深入了解其中具體機制奠定基礎,從而期望為臨床MI后抑郁患者尋找新的靶點,改善患者生活質量,降低社會經濟負擔。
二、材料
1. 實驗動物 湖北省疾病預防控制中心提供的體重為200~220 g,100只SPF級健康雄性Wistar大鼠,由武漢大學人民醫院動物房飼養,飼養條件符合實驗要求。
2. 主要實驗儀器 如表3-6所示。

注:其他常用耗材均由武漢大學人民醫院心血管病研究所實驗室提供。
3. 主要實驗試劑 如表3-7所示。


注:其他實驗的常用試劑均由武漢大學基礎醫學院病理生理實驗室提供。
此外,離體灌流的試劑如下:正常臺氏液的配制為NaCl(58.44 mmol/L)、KCl(74.55 mmol/L)、CaCl2(110.98 mmol/L)、MgCl2(203.30 mmol/L)、NH2PO3(156.01 mmol/L)、 HEPES(238.30 mmol/L)、葡萄糖(198.17 mmol/L),然后用NaOH調pH至7.35。
三、實驗方法
1. 實驗動物分組 將購買于由湖北省疾病預防控制中心、置于武漢大學人民醫院動物房飼養的100只Wistar大鼠,按假手術組(n=10)、MI組(n=20)、抑郁組(n=10)、模型組(n=20)、激動劑組(n=20)、拮抗劑組(n=20)隨機分為6組;通過結扎冠狀動脈左前降支方法建立MI模型,給予慢性不可預見性溫和刺激28天建立抑郁模型,在急性MI模型建立后第2天隨即給予慢性不可預見性溫和刺激建立MI后抑郁模型。
2. 動物處理方法
(1) 假手術組:冠狀動脈左前降支只掛線不結扎,從第2天開始持續到實驗結束需要28天,在實驗階段保持每天用5 mL/kg的生理鹽水灌胃。
(2) MI組:在行冠狀動脈左前降支結扎制作急性MI模型之后,每天用5 mL/kg生理鹽水灌胃,持續28天正常喂養。
(3) 抑郁組:正常喂養,按程序每天予以慢性不可預見性溫和應激刺激,之后與MI組以相同方式灌胃,連續28天。
(4) 模型組:正常喂養,冠狀動脈左前降支結扎制作MI模型后,按程序每天予以慢性溫和應激刺激,之后與MI組以相同方式每天灌胃,連續28天。
(5) 激動劑組:正常喂養,冠狀動脈左前降支結扎制作MI模型后,按程序每天予以慢性溫和應激刺激,同時每天用0.03%SA4503藥液1 mL/kg(即0.3 mg/kg)灌胃1次,連續28天。
(6) 拮抗劑組:正常喂養,前冠狀動脈左前降支結扎制作MI模型后,按程序每天予以慢性溫和應激刺激,同時每天腹腔注射0.1%BD1063藥液1 mL/kg(即1 mg/kg)1次,連續28天。
各組模型制作完成后,于實驗第5周進行行為學及電生理指標檢測。
3. 動物模型的制作
(1) 急性MI模型:依據相關文獻建立急性MI模型。稱取Wistar大鼠,記錄重量;抽取一定量麻醉藥1%戊巴比妥鈉溶液(4 mL/kg大鼠),腹腔注射麻醉大鼠,進針后注意回抽是否有血,避免麻醉藥進入血管。觀察大鼠肌力、反應狀態,時間8~15 min;將麻醉好的大鼠仰臥置于木板上固定四肢,逆向剃除頸前區及左胸部的鼠毛。上述操作均在動物準備間進行;手術者對頸前部及左胸部進行碘酒消毒;助手打開氧氣瓶閥門,調節壓力,打開動物呼吸機開關,調節頻率到70 Hz,連接靜脈置管與氧氣管,調節壓力到2 kPa;術者剪開頸前部皮膚,用組織鑷逐層分離組織,注意邊分離,邊止血。在環狀軟骨下1~2軟骨環進行氣管插管,插管時傾斜一定角度插入后氣管插管與氣管平行進入,注意無阻力感,插入后打開靜脈置管,注意動態觀察動物呼吸機壓力。術者剪開胸骨旁左側皮膚,逐層分離組織,注意夾閉肋骨1 min進行止血,然后夾斷第2或第3肋,小心撕開心包膜,找到左心耳,在其起源處往下1~2 mm處結扎冠狀動脈左前降支,以心電圖Ⅰ、Ⅱ、aVL導聯ST段抬高0.2 mV作為手術成功標志,更為直接證據為缺血區域變白。關閉胸腔,依次縫合各層組織,待大鼠恢復自主呼吸后拔出氣管插管。再次消毒頸部及心前區皮膚。最后將大鼠放回鼠籠,正常進食水。肌注80萬U青霉素3天,防止感染。
(2) 慢性不可預見性溫和應激制作抑郁模型:利用慢性不可預見性溫和應激(CUMS)制作抑郁模型。抑郁組、模型組、激動劑組及拮抗劑組大鼠從MI手術后第2天開始,每天定點給予隨機某種輕度刺激,每天刺激時間、種類不同,以使動物不能預料刺激的發生,連續28天。這些刺激包括:鼠籠45°傾斜持續24 h,鋪潮濕墊料持續24 h,禁食持續24 h,禁水持續24 h,4 ℃冰水游泳5 min,42 ℃熱水游泳5 min,夾尾1 h,鼠籠搖晃15 min,晝夜顛倒24 h,捕食者聲音刺激30 min。假手術組及MI組不予任何刺激。連續2天不給予相同刺激。
4. 行為學指標檢測
(1) 糖水消耗實驗
①實驗前先訓練大鼠糖水適應性:用燒杯量取500 mL去離子水;在稱重器置稱量紙一張,調零,稱取5 g蔗糖,注意不要將蔗糖撒到稱量紙之外,保持稱重器干燥;將5 g蔗糖溶于裝有500 mL去離子水的燒杯中,將燒杯置于攪拌器上,調整轉速,注意避免液體濺出燒杯外,待蔗糖完全溶解后,關閉攪拌器,將配好的1%蔗糖溶液灌入飲水瓶中;按上述步驟配好其余飲水瓶的1%蔗糖溶液。
②每個鼠籠放2瓶糖水,觀察24 h糖水消耗情況。第二個24 h:用燒杯量取500 mL去離子水;按照前述方法配制1%蔗糖溶液;每個鼠籠放置糖水、純水各一瓶(500 mL、500 mL),觀察24 h糖水、純水消耗情況。第三個24 h禁食禁水。
③于72 h后,做動物的基礎糖水/純水消耗實驗:同時給予每只大鼠一定量的兩瓶水,重量相同,一瓶1%蔗糖水及一瓶純水。2 h后,取兩瓶水再次稱重,記錄大鼠蔗糖水減少及純水減少量。動物的糖水偏愛百分比的計算方法:糖水偏愛百分比=糖水消耗量/(糖水消耗量+純水消耗量)×100%。
(2) 曠場實驗:本研究所要用的曠場為無蓋的長方體鐵箱,長120 cm,寬90 cm,高35 cm。本研究實驗均在早上9:00—10:00進行,條件均為在安靜的房間內,避免各種嘈雜環境的影響。記錄時主要采用動物行為自動跟蹤系統記錄大鼠于曠場內10 min的運動情況,檢測時注意將Wistar大鼠置于曠場中心,然后分析比較主要觀測指標。直立次數則是由實驗者自行記錄,將測試大鼠兩前爪騰空、攀附墻壁、離開地面1 cm,無論大鼠攀附墻壁多長時間,只要符合前述要求條件,直至大鼠兩前爪放下為直立1次。系統會記錄大鼠運動總行程及平均運動速度,實驗員會在每只動物單獨測試后及需要馬上測試的動物之間徹底清潔曠場,并盡量保證測試環境安靜,排除大鼠氣味、噪聲等其他因素對其運動的影響。
5. 心肌組織中Sigma-1受體的檢測
(1) 心肌組織分離:各組模型建立后,用1%戊巴比妥鈉麻醉動物,待完全麻醉后迅速將大鼠頭部置于冰上。利用彎鑷稍提起心臟,于主動脈根部剪取心臟。于冰上去除心臟表面多余組織,剪取左心室部位心肌組織。所取組織立即用錫箔紙包好置于冰里的EP管內,防止蛋白變性,并用記號筆標記標本號,并迅速置于-80℃冰箱保存備用。最后須標記好標本位置,以便取放。
(2) 總蛋白提取:取出-80 ℃冰箱中心肌組織,并將其剪切成組織碎片,將RIPA裂解液加入PMSF中。將心肌組織按照20 mg∶(150~250) μL的比例加入裂解液,勻漿,裂解,然后預冷至4 ℃。將有裂解液的EP管平置于離心機中,離心3~5 min,取上清液,即為總蛋白樣品,放EP管內。測蛋白濃度,剩余樣品按比例加緩沖液,混勻,吹打,將剩余樣品完成混勻及吹打后,放入100 ℃沸水中5 min使蛋白變性。之后再放置于-20 ℃冰箱內保存為以后進行Western Blot檢測做準備。
(3) Western Blot檢測
①電泳:將清洗干凈的玻璃板晾干,然后使之對齊,放入夾子中卡緊。將12%濃度的分離膠加TEMED后立即搖勻即可灌膠,膠上加水密封。之后靜置約30 min,待膠凝固后,倒去膠上層水,用無水乙醇沖洗2遍后吸干殘存乙醇。用5%的濃縮膠加入TEMED后搖晃勻。之后進行灌膠并插梳。插梳30 min左右拔出,并置于4 ℃過夜備用。將電泳槽內加入一倍的電泳緩沖液,須注意電泳緩沖液液面需高于凝膠最上端。(心室組織)80 μg已變性的蛋白樣品,依據已測到的總蛋白濃度計算所需上樣的量,用微量移液器吸取相應量,加到上樣孔里,加入預染蛋白,確定蛋白條帶的相對分子質量大小。溴酚藍跑至最底部即可結束電泳(電壓為80 V至120 V)。
②轉膜:浸泡并浸洗PVDF膜。加轉膜液到搪瓷盤內,放入海綿墊和濾紙。水平打開夾子,墊上海綿墊,同時墊上濾紙,除去氣泡。除去玻璃板,剝下分離膠置于濾紙正中。將膜蓋于膠上,另一面蓋上三張濾紙并除去氣泡。蓋上另外的海綿墊,合起夾子,注意趕走夾子里的氣體。合上夾子放進轉印槽中進行轉膜。在PVDF膜上做記號以判斷膜的正反面。
③免疫反應:將PVDF膜置于平皿中加入封閉液脫色 1 h。而后取出膜將其置于抗體孵育盒中,加入一抗孵育液(一抗稀釋液加入Sigma-1受體抗體(1∶1000))(檢測GAPDH蛋白表達水平作為內參照),4 ℃孵育過夜,然后脫色洗25 min,共5次。在二抗稀釋液中加入HRP標記的二抗(1∶3000),孵育1 h,同樣脫色洗。
④化學發光、顯影及定影:按每10 cm2膜加1 mL ECL工作液的比例,使膜蛋白面與工作液充分均勻接觸,然后用保鮮膜包好,放入X光片夾中。在暗室中,將顯影液和定影液倒入塑料盤中,在紅燈照射下取出X線光片,剪裁成適當大小(比膜的長和寬均需大1 cm)。打開X線光片夾,把X線光片置于膜上,合上X線光片夾。待曝光結束后,取出X線光片,浸入顯影液中30 s,待出現明顯條帶后,即可停止顯影。立刻將X線光片浸入定影液1 min,沖洗膠片,沖去定影液,晾干。掃描膠片,然后用Quantity One系統軟件進行條帶灰度值分析,計算目的蛋白相對含量。
6. 離體灌流檢測室性心動過速的發生 各組大鼠利用苯巴比妥鈉進行腹腔麻醉(40 mg/kg),經腹腔注射肝素鈉(100 IU),等待10 min后,剪開胸腔,減掉多余組織,迅速取出心臟連接于Langerdorff心臟灌流裝置上,逆行灌流,灌流速度為2~2.5 mL/min,灌注壓穩定在60~80 mmHg,灌注10 min。
心律失常誘發:將ECG電極置于右心房后壁和心尖部模擬心電圖。將電極放置在右心室基底部起搏心臟。利用單相動作電位(MAP)電極記錄左心室動作電位,分析單相動作電位復極90%時程MAPD90。基線穩定10 min后行程控刺激(8個S1刺激加單個期前刺激S2,S2從250 ms開始,以-10 ms反掃)和Burst刺激觀察室性心律失常誘發情況。室性心動過速定義為出現5個及以上室性期前收縮,包括室性心動過速及心室顫動。室性心動過速誘發率為:各組大鼠誘發陽性的只數/總大鼠的只數×100%。持續時間為各組大鼠發生室性心動過速的時間。
7. 統計學處理 以各目的蛋白OD值與GAPDH蛋白OD值的比值為目的蛋白相對表達量,以對照組目的蛋白表達水平為1(100%),計算各組目的蛋白相對表達水平。所有計量數據均以均數±標準差表示,造模行為學、Western Blot及離體電生理數據兩組間比較采用兩個獨立樣本間t檢驗,多組間比較用方差分析(ANOVA),計數數據用率(%)表示,組間比較用χ2檢驗。所有數據均利用SPSS 21.0軟件包進行統計學分析,以P<0.05表示差異有統計學意義。
四、實驗結果
1. 動物模型 急性MI模型制作心電圖如圖3-6所示。

圖3-6 急性MI模型制作心電圖
注:(a)表示術前體表心電圖ST段未發現異常;(b)術后體表心電圖,顯示Ⅱ導聯ST段抬高與T波融合,提示MI模型制作成功。
2. 干預對MI后抑郁動物行為學影響
(1) 糖水消耗實驗:如圖3-7所示。

圖3-7 各組大鼠糖水偏愛百分比的比較
注:與假手術組相比,MI組、抑郁組和模型組糖水消耗均有減少;與MI組相比,模型組糖水消耗顯著減少;與模型組相比,激動劑干預后糖水消耗增加,拮抗劑干預則是相反的;拮抗劑組相對于激動劑組糖水消耗顯著減少。*P<0.05,與假手術組比較;#P<0.05,與MI組比較;**P<0.05,與模型組比較。
(2) 曠場實驗
①總行程:如圖3-8所示。

圖3-8 各組大鼠總行程的比較
注:與假手術組相比,MI組、抑郁組和模型組均有總行程減少;與MI組相比,模型組總行程減少;激動劑干預后,動物運動增加;拮抗劑干預則相反;拮抗劑組相對于激動劑組總行程顯著減少。*P<0.05,與假手術組比較;#P<0.05,與MI組比較;**P<0.05,與模型組比較。
②運動速度:如圖3-9所示。

圖3-9 各組大鼠運動速度的比較
注:與假手術組相比,MI組、抑郁組和模型組均有運動速度減慢;與MI組相比,模型組速度顯著減慢;激動劑干預后,大鼠運動速度增加;拮抗劑干預后速度下降,但無統計學意義;拮抗劑組相對于激動劑組速度顯著減少。*P<0.05,與假手術組比較;#P<0.05,與MI組比較;**P<0.05,與模型組比較。③直立次數:如圖3-10所示。

圖3-10 各組大鼠直立次數的比較
注:與假手術組相比,MI組、抑郁組和模型組均有直立次數減少,顯示大鼠活動度降低;與MI組相比,模型組直立次數減少;激動劑干預后,動物直立次數增加;拮抗劑干預后直立次數減少,但無統計學意義;拮抗劑組相對于激動劑組直立次數顯著減少。*P<0.05,與假手術組比較;#P<0.05,與MI組比較;**P<0.05,與模型組比較。
3. 干預對MI后抑郁大鼠室性心動過速的影響
(1) 室性心動過速誘發率:如圖3-11所示。

圖3-11 各組大鼠室性心動過速誘發率的比較
注:與假手術組相比,MI組、抑郁組和模型組室性心律失常誘發率均較高;與MI組相比,模型組誘發率顯著升高;與模型組相比,激動劑干預后誘發率降低;拮抗劑干預則相反;拮抗劑組相對于激動劑組誘發率是顯著增加的。*P<0.05,與假手術組比較;#P<0.05,與MI組比較;**P<0.05,與模型組比較。
(2) 室性心動過速持續時間:如圖3-12所示。

圖3-12 各組大鼠室性心動過速持續時間的比較
注:與假手術組相比,MI組、抑郁組和模型組室性心動過速持續時間均較長;與MI組相比,模型組持續時間顯著延長;與模型組相比,激動劑干預后時間縮短;拮抗劑干預則相反;拮抗劑組相對于激動劑組室性心動過速持續時間顯著增長。*P<0.05,與假手術組比較;#P<0.05,與MI組比較;**P<0.05,與模型組比較。
4. 干預對MI后抑郁大鼠心肌組織Sigma-1受體表達的影響 如圖3-13所示。

圖3-13 各組大鼠心肌組織Sigma-1受體表達的比較
注:(a)表示各組大鼠心肌組織Sigma1 受體及內參表達情況;(b)表示Sigma-1受體與內參的比值情況。sham,假手術組;MI,MI組;MDD,抑郁組;MD,模型組;MDS,激動劑組;MDB,拮抗劑組。與假手術組相比,MI組Sigma-1受體表達顯著下降,模型組無顯著性差異;與模型組比較,激動劑干預后表達增加,拮抗劑干預則相反;拮抗劑組相對于激動劑組表達減少。*P<0.05,與假手術組比較;**P<0.05,與模型組比較。
五、討論
2010年,在美國據估計有379559人因冠心病而死亡。在英國,這個數字超過65000,因冠心病而死亡的人數高于其他任何疾病。在發展中國家,因心血管疾病而死亡的人數居首位,而其中冠心病的發病率和死亡率呈指數增加。2008年全球估計有730萬人死于冠心病,因此,它成為全世界患病者死亡的主要原因。另一個常見的疾病是抑郁癥。在美國,它影響26%的女性和18%的男性。前瞻性Meta分析研究發現抑郁癥患者出現冠心病的概率較高,這嚴重地影響了公眾的身心健康。因此,尚需進一步研究抑郁癥如何導致冠心病患者的死亡風險增加的潛在機制。最新研究顯示女性患者的這種風險尤其增加。因此,如何降低冠心病合并抑郁癥患者的心臟性事件發生率和猝死率是當前研究的重點和難點。故本研究將急性MI模型與慢性不可預見性溫和應激模型相結合建立MI后抑郁模型,然后通過糖水消耗實驗和曠場實驗對實驗模型動物進行行為學評估,并分析藥物干預對MI后抑郁大鼠行為學、電生理及相關蛋白表達的影響。
1. 動物模型 本研究依然采用與之前相同的經典的方法進行MI模型制作,通過結扎冠狀動脈左前降支,觀察到心肌顏色變紫、變白。同時體表心電圖記錄到較為典型的MI心電圖表現。抑郁模型通過給予28天7種不同溫和刺激,并應用行為學評價方法進行檢測。結果顯示MI模型及抑郁模型及MI后抑郁模型的制作都是成功的。
2. 行為學 本實驗采用糖水消耗實驗及曠場實驗評價大鼠的行為學變化。結果提示抑郁組、MI組及模型組大鼠這些行為學改變較對照組顯著,與臨床抑郁癥的表現相似。同時與MI組相比,模型組前述指標也是下降的。因此,本研究表明MI增加大鼠抑郁樣行為的發生率,給予拮抗劑則使其加重,給予Sigma-1受體激動劑則可明顯改善行為學指標。這一結果也驗證了MI與抑郁的共病特點,同時說明Sigma-1受體在其中的重要調控作用。同時為臨床醫生提出線索:對于MI恢復期患者,我們不僅要注意對冠心病進行經典的二級預防,更需關注患者的內在情感狀態,讓患者更好地去適應社會大環境。
3. Sigma-1受體 早期研究發現Sigma-1受體是擁有一個短的N端及長的C端,有兩個跨膜區域的膜蛋白受體。Sigma-1受體位于胞質內質網線粒體結合處,此處叫線粒體相關的內質網膜,先前研究表明其與多數細胞成分相互作用,如G蛋白耦聯受體(GPCR)及離子通道等。重要的是,它與5-HT受體相似,能激活或拮抗鈣離子活性,因此可以調節胞內鈣離子水平。本研究的實驗數據證實了Sigma-1受體在MI后抑郁動物模型的心臟表達情況。結果與先前研究基本一致,MI組Sigma-1受體的表達較假手術組顯著降低,模型組表達量也是下降的,但無統計學差異。在同時給予Sigma-1受體激動劑(SA4503)后Sigma-1受體表達上調,顯著高于模型組,而給予拮抗劑(BD1063)干預后Sigma-1受體的表達顯著低于激動劑組。而本研究結果發現模型組與心梗組相比,Sigma-1受體表達增加,推測可能是本實驗模型不同于以往實驗研究的單一MI模型,或者單一抑郁模型。本研究是MI之后給予慢性不可預見性溫和刺激建立MI后抑郁模型,影響因素較之前復雜。其次,受體表達量增加或減少與其功能不一定呈正相關。但是我們在給予激動劑及拮抗劑后發現Sigma-1受體的預期相應變化。這已充分說明Sigma-1受體在MI后抑郁模型中起到重要作用。
最近,Fukunaga和同事報告了左心室Sigma-1受體表達下降參與左心室肥大的進程,Sigma-1受體在左心室的表達量和心力衰竭之間呈顯著的負相關。這些發現表明Sigma-1受體在心血管疾病的病理生理機制中起著重要作用。這和本研究結果一致。同時還有研究發現,作為5羥色胺再攝取抑制劑,氟伏沙明已經顯示出心血管保護作用,而且是強大的Sigma-1受體激動劑。氟伏沙明干預切除卵巢的大鼠可顯著降低心肌肥大的程度,同時能上調Sigma-1受體在左心室的表達。本實驗中MI組相對于假手術組Sigma-1受體的表達明顯下降,模型組大鼠給予Sigma-1受體激動劑SA4503使Sigma-1受體表達上調,而拮抗劑則相反。以上體現了Sigma-1受體的變化與MI和抑郁的發病機制存在密切關聯。
4. Sigma-1受體與電生理特性 本實驗在MI抑郁模型中證實了Sigma-1受體與室性心律失常的關系,并正反論證了其對心臟的作用效果。結果顯示與假手術組相比較,MI組持續時間明顯延長,誘發率也顯著增高,模型組與MI組相比,室性心動過速持續時間也是顯著增加的。而給予Sigma-1受體激動劑后室性心動過速持續時間顯著縮短,室性心動過速不易誘發,拮抗劑則相反。以上結果提示了Sigma-1受體的增加能夠使室性心動過速發生明顯減少,具有顯著的心臟保護作用。本研究的成功驗證為后續的器官、組織及細胞水平的研究提供了方向及依據。
既往研究發現Sigma-1受體能在胞內跨膜移動。在那里它們能結合各種離子通道、受體激酶,來調節多種神經遞質。Sigma-1受體具有抗心律失常,調節心臟收縮和血管舒縮性、緊張性的功能。在心血管障礙研究中發現給予去除卵巢的大鼠脫氫表雄酮(DNEA,一種Sigma-1受體激動劑)可緩解壓力誘導的心肌肥厚。Sigma-1受體對心臟功能的影響可能是由離子通道介導的。因此,Sigma-1受體可能是調節各種介導心律失常的離子通道的關鍵分子,而具體機制尚未闡明。近幾年有研究發現腦源性神經營養因子(BDNF)/TrkB信號通路可能介導了Sigma-1受體的此作用。多個研究表明BDNF/TrkB信號通路參與了抑郁及心血管疾病發生發展的病理生理過程。Monteggia等人發現條件性敲除BDNF,模型小鼠也表現出抑郁樣行為,強化了強迫游泳和糖水消耗實驗結果,提示低水平的BDNF可能導致抑郁癥,通過病毒介導的轉基因手段也發現了它在抑郁癥中的作用。因此,多個數據顯示BDNF可能是抑郁癥發生的其中一個環節。同時于2012年Okada等人報道BDNF誘導的中樞神經介導的機制通過TrkB途徑可以防止MI后的心肌重塑,改善心功能。BDNF敲除使得MI 后2周小鼠心臟增大,心肌細胞死亡數顯著增加。而若心臟組織敲除TrkB基因,同樣可導致MI后心功能惡化。MI后血漿BDNF水平明顯升高,這與大腦而不是心臟中的BDNF上調顯著相關。此外,周圍BDNF的增加顯著恢復了大腦中BDNF缺失的小鼠心臟表型。這些發現表明,BDNF的神經保護作用是通過中樞神經系統相關的通路介導的。以上研究結果表明BDNF/TrkB信號通路在心臟功能障礙中起到關鍵作用。最近,Itoh等人報道,大腦中Sigma-1受體水平的下降影響心力衰竭和抑郁癥之間的關系。主動脈縮窄及高鹽飲食誘導的心肌功能損害的小鼠的大腦中Sigma-1受體水平降低,表現出抑郁樣行為。經側腦室注入Sigma-1受體激動劑PRE084,可增加大腦Sigma-1受體的表達,降低交感神經活性,改善心臟功能和抑郁樣行為。相比之下,在假手術組的大鼠側腦室注射Sigma-1受體拮抗劑能增加交感神經活性、降低心臟功能。在本研究中,應用BD1063顯著增加了室性心律失常的發生率,與之前關于心臟功能方面的研究結果基本一致。
最近,Fujimoto等人發現cutamesine增加Sigma-1受體的表達,同時增加內源性BDNF的分泌,提示BDNF是由Sigma-1受體調節的。Sigma-1受體表達增加,促使前體BDNF(pro BDNF)向成熟BDNF轉變,這就增加了BDNF向細胞外的分泌,從而發揮其作用。這些證據表明Sigma-1受體的激活會增強伴侶的活性,反過來調節BDNF的表達,也能抑制ER誘導的蛋白增加BDNF的表達,這在心臟病和心理疾病中有著重要作用。因此,Sigma-1受體的刺激似乎增加BDNF的分泌,也可以產生對心血管功能的有益影響。盡管有上述如此多的研究,Sigma-1受體和BDNF/TrkB信號通路之間的關系在心血管疾病及精神疾病的共病機制中的作用尚需進一步研究,同時其下游的離子,甚至分子機制尚未涉及,這為我們進一步研究提出了方向。
綜上所述,Sigma-1受體可能是心血管疾病及精神疾病的共同靶點,介導兩者的共同發生發展,然而具體機制尚不清楚。本研究已證實應用Sigma-1受體激動劑可改善模型大鼠行為學及電生理活性,而應用拮抗劑則相反。說明Sigma-1受體激動劑對心臟有一種保護作用。后續研究希望能闡明其中的詳細機制。然而本研究局限性在于驗證方法單一,后續研究尚需進一步利用多種方法進行理論驗證,同時需要更多的臨床樣本研究來支持論證。
六、結論
Sigma-1受體對MI后抑郁大鼠室性心動過速的發生具有重要調控作用,激動Sigma-1受體可防止心梗后抑郁大鼠心動過速的發生。
參考文獻
[1]Strik J J,Honig A,Maes M.Depression and myocardial infarction:relationship between heart and mind[J].Prog Neuropsychopharmacol Biol psychiatry,2001,25(4):879-892.
[2]Meijer A,Conradi H J,Bos EH,et al.Prognostic association of depression following myocardial infarction with mortality and cardiovascular events:a metaanalysis of 25 years of research[J].General Hospital Psychiatry,2011,33(3):203-216.
[3]Neelakantan S.Psychology:Mind over myocardium[J].Nature,2013,493(7434):S16-S17.
[4]石少波,楊波,梁錦軍.抑郁癥與室性心律失常[J].中國心臟起搏與心電生理雜志,2012,26(5):386-388.
[5]Shi S,Liang J,Liu T,et al.Depression increases sympathetic activity and exacerbates myocardial remodeling after myocardial infarction:evidence from an animal experiment[J].PloS one,2014,9(7):e101734.
[6]Hellewell S B,Bowen W D.A sigma-like binding site in rat pheochromocytoma(PC12)cells:decreased affinity for(+)-benzomorphans and lower molecular weight suggest a different sigma receptor form from that of guinea pig brain[J].Brain Research,1990,527(2):244-253.
[7]Bowen W D,DeCosta B,Hellewell S B,et al.Characterization of[3H](+)-pentazocine,a highly selective sigma ligand[J].Prog Clin Biol Res,1990,328:117-120.
[8]Jin J L,Fang M,Zhao Y X,et al.Roles of Sigma1 receptors in Alzheimer's disease[J].International Journal of Clinical and Experimental Medicine,2015,8(4):4808-4820.
[9]Hanner M,Moebius F F,Flandorfer A,et al.Purification,molecular cloning,and expression of the mammalian sigmal-binding site[J].Proc Natl Acad Sci U S A,1996,93(15):8072-8077.
[10]Hayashi T,Su T P.Sigma-1 receptor chaperones at the ER-mitochondrion interface regulate Ca(2+)signaling and cell survival[J].Cell,2007,131(3):596-610.
[11]Hayashi T,Su T P.Sigma-1 receptors(sigma(1)binding sites)form raftlike microdomains and target lipid droplets on the endoplasmic reticulum:roles in endoplasmic reticulum lipid compartmentalization and export[J].The Journal of Pharmacology and Experimental Therapeutics,2003,306(2):718-725.
[12]Mavlyutov T A,Epstein M L,Andersen K A,et al.The Sigma-1 receptor is enriched in postsynaptic sites of C-terminals in mouse motoneurons.An anatomical and behavioral study[J].Neuroscience,2010,167(2):247-255.
[13]Alonso G,Phan V,Guillemain I,et al.Immunocytochemical localization of the sigma(1)receptor in the adult rat central nervous system[J].Neuroscience,2000,97(1):155-170.
[14]Chen Y,Hajipour A R,Sievert M K,et al.Characterization of the cocaine binding site on the Sigma-1 receptor[J].Biochemistry,2007,46(11):3532-3542.
[15]Chevallier N,Keller E,Maurice T.Behavioural phenotyping of knockout mice for the Sigma-1(sigma(1))chaperone protein revealed gender-related anxiety,depressive-like and memory alterations[J].J Psychopharmacol,2011,25(7):960-975.
[16]Niitsu T,Iyo M,Hashimoto K.Sigma-1 receptor agonists as therapeutic drugs for cognitive impairment in neuropsychiatric diseases[J].Current Pharmaceutical Design,2012,18(7):875-883.
[17]Hashimoto K.Sigma-1 receptor chaperone and brainderived neurotrophic factor:emerging links between cardiovascular disease and depression[J].Progress in Neurobiology.2013,100:15-29.
[18]Abou-Lovergne A,Collado-Hilly M,Monnet F P,et al.Investigation of the role of sigmal-receptors in inositol 1,4,5-trisphosphate dependent calcium signaling in hepatocytes[J].Cell Calcium,2011,50(1):62-72.
[19]Mueller B H 2nd,Park Y,Daudt D R 3rd,et al.Sigma-1 receptor stimulation attenuates calcium influx through activated L-type Voltage Gated Calcium Channels in purified retinal ganglion cells[J].Exp Eye Res,2013,107:21-31.
[20]Shen Y C,Wang Y H,Chou Y C,et al.Dimemorfan protects rats against ischemic stroke through activation of Sigma-1 receptor-mediated mechanisms by decreasing glutamate accumulation[J].Journal of Neurochemistry,2008,104(2):558-572.
[21]Tsai S Y,Hayashi T,Harvey B K,et al.Sigma-1 receptors regulate hippocampal dendritic spine formation via a free radical-sensitive mechanism involving Rac1xGTP pathway[J].Proc Natl Acad Sci U S A,2009,106(52):22468-22473.
[22]Martina M,Turcotte M E,Halman S,et al.The Sigma-1 receptor modulates NMDA receptor synaptic transmission and plasticity via SK channels in rat hippocampus[J].The Journal of Physiology,2007,578(Pt 1):143-157.
[23]Bermack J E,Debonnel G.The role of sigma receptors in depression[J].Journal of Pharmacological Sciences,2005,97(3):317-336.
[24]Skuza G,Rogóz Z.Antidepressant-like effect of PRE084,a selective sigma1 receptor agonist,in Albino Swiss and C57BL/6J mice[J].Pharmacological reports:PR,2009,61(6):1179-1183.
[25]Monnet F P.Sigma-1 receptor as regulator of neuronal intracellular Ca2+:clinical and therapeutic relevance[J].Biol Cell,2005,97(12):873-883.
[26]Kurata K,Takebayashi M,Morinobu S,et al.Beta-estradiol,dehydroepiandrosterone,and dehydroepiandrosterone sulfate protect against N-methyl-D-aspartate-induced neurotoxicity in rat hippocampal neurons by different mechanisms[J].The Journal of Pharmacology and Experimental Therapeutics,2004,311(1):237-245.
[27]Zhang X J,Liu L L,Jiang S X,et al.Activation of the receptor 1 suppresses NMDA responses in rat retinal ganglion cells[J].Neuroscience,2011,177:12-22.
[28]瞿偉駿,沙莎,陳玲.Sigma-1受體基因敲除誘發雄鼠抑郁樣行為[J].南京醫科大學學報(自然科學版),2013,33(4):421-425.
[29]David D J,Samuels B A,Rainer Q,et al.Neurogenesisdependent and independent effects of fluoxetine in an animal model of anxiety/depression[J].Neuron,2009,62(4):479-493.
[30]Waterhouse R N,Chang R C,Atuehene N,et al.In vitro and in vivo binding of neuroactive steroids to the Sigma1 receptor as measured with the positron emission tomography radioligand[18F]FPS[J].Synapse,2007,61(7):540-546.
[31]Hashimoto K,Ishiwata K.Sigma receptor ligands:possible application as therapeutic drugs and as radiopharmaceuticals[J].Current pharmaceutical design,2006,12(30):3857-3876.
[32]Bhuiyan M S,Fukunaga K.Targeting Sigma-1 receptor signaling by endogenous ligands for cardioprotection[J].Expert Opin Ther Targets,2011,15(2):145-155.
[33]Ito K,Hirooka Y,Sunagawa K.Brain Sigma-1 receptor stimulation improves mental disorder and cardiac function in mice with myocardial infarction[J].Journal of Cardiovascular Pharmacology,2013,62(2):222-228.
[34]Degabriele N M,Griesenbach U,Sato K,et al.Critical appraisal of the mouse model of myocardial infarction[J].Exp Physiol,2004,89(4):497-505.
[35]Grippo A J,Beltz T G,Johnson A K.Behavioral and cardiovascular changes in the chronic mild stress model of depression[J].Physiology & Behavior,2003,78(45):703-710.
[36]Mozaffarian D,Benjamin E J,Go A S,et al.Heart Disease and Stroke Statistics-2016 Update:A Report from the American Heart Association[J].Circulation,2016,133(4):e38-e360.
[37]Wu Q,Kling J M.Depression and the risk of myocardial infarction and coronary death:a meta-analysis of prospective cohort studies[J].Medicine(Baltimore),2016,95(6):e2815.
[38]Shim R S,Baltrus P,Ye J,et al.Prevalence,treatment,and control of depressive symptoms in the United States:results from the National Health and Nutrition Examination Survey(NHANES),2005-2008[J].J Am Board Fam Med,2011,24(1):33-38.
[39]O’Neil A,Fisher A J,Kibbey K J,et al.Depression is a risk factor for incident coronary heart disease in women:An 18-year longitudinal study[J].Journal of Affective Disorders,2016,196:117-124.
[40]Bisagno V,Grillo C A,Piroli G G,et al.Chronic stress alters amphetamine effects on behavior and synaptophysin levels in female rats[J].Pharmacology,Biochemistry,and Behavior,2004,78(3):541-550.
[41]Szabo A.Psychedelics and immunomodulation:novel approaches and therapeutic opportunities[J].Front Immunol,2015,6:358.
[42]Bhuiyan M S,Tagashira H,Shioda N,et al.Targeting Sigma-1 receptor with fluvoxamine ameliorates pressureoverloadinduced hypertrophy and dysfunctions[J].Expert Opin Ther Targets,2010,14(10):1009-1022.
[43]Bhuiyan M S,Fukunaga K.Stimulation of Sigma-1 receptor signaling by dehydroepiandrosterone ameliorates pressure overloadinduced hypertrophy and dysfunctions in ovariectomized rats[J].Expert Opin Ther Targets,2009,13(11):1253-1265.
[44]Skuza G,Kolasiewicz W.Repeated treatment with SA4503,a selective sigma1 receptor agonist,up-regulates alpha-adrenergic system.a behavioral study[J].Polish Journal of Pharmacology,2001,53(5):547-550.
[45]Ault D T,Werling L L.Phencyclidine and dizocilpine modulate dopamine release from rat nucleus accumbens via sigma receptors[J].European Journal of Pharmacology,1999,386(2-3):145-153.
[46]Chaldakov G N,Fiore M,Stankulov I S,et al.Neurotrophin presence in human coronary atherosclerosis and metabolic syndrome:a role for NGF and BDNF in cardiovascular disease?[J].Prog Brain Res,2004,146:279-289.
[47]Donovan M J,Lin M I,Wiegn P,et al.Brain derived neurotrophic factor is an endothelial cell survival factor required for intramyocardial vessel stabilization[J].Development,2000,127(21):4531-4540.
[48]Nakamura K,Martin K C,Jackson J K,et al.Brain-derived neurotrophic factor activation of TrkB induces vascular endothelial growth factor expression via hypoxia-inducible factor1alpha in neuroblastoma cells[J].Cancer Res,2006,66(8):4249-4255.
[49]Monteggia L M,Luikart B,Barrot M,et al.Brain-derived neurotrophic factor conditional knockouts show gender differences in depression-related behaviors[J].Biological Psychiatry,2007,61(2):187-197.
[50]Murrough J W.Ketamine as a novel antidepressant:from synapse to behavior[J].Clin Pharmacol Ther,2012,91(2):303-309.
[51]Okada S,Yokoyama M,Toko H,et al.Brain-derived neurotrophic factor protects against cardiac dysfunction after myocardial infarction via a central nervous system-mediated pathway[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2012,32(8):1902-1909.
[52]Ito K,Hirooka Y,Matsukawa R,et al.Decreased brain Sigma-1 receptor contributes to the relationship between heart failure and depression[J].Cardiovascular Research,2012,93(1):33-40.
[53]Fujimoto M,Hayashi T,Urfer R,et al.Sigma-1 receptor chaperones regulate the secretion of brainderived neurotrophic factor[J].Synapse,2012,66(7):630-639.
[54]Bhuiyan M S,Tagashira H,Fukunaga K.Sigma1 receptor stimulation with fluvoxamine activates Akt-eNOS signaling in the thoracic aorta of ovariectomized rats with abdominal aortic banding[J].European Journal of Pharmacology,2011,650(2-3):621-628.
[55]Tagashira H,Zhang C,Lu Y M,et al.Stimulation of σ1-receptor restores abnormal mitochondrial Ca2+ mobilization and ATP production following cardiac hypertrophy[J].Biochimica et Biophysica Acta,2013,1830(4):3082-3094.
[56]Tagashira H,Bhuiyan MS,Shioda N,et al.Fluvoxamine rescues mitochondrial Ca2+ transport and ATP production through σ(1)-receptor in hypertrophic cardiomyocytes[J].Life Sci,2014,95(2):89-100.
[57]Zhang H,Cuevas J.Sigma receptor activation blocks potassium channels and depresses neuroexcitability in rat intracardiac neurons[J].The Journal of Pharmacology and Experimental Therapeutics,2005,313(3):1387-1396.
轉載自頭條號:華中科技大學出版社。(如果侵犯你的權益可以下面留言我刪除,也可以聯系網站管理員刪除)